Серьезной проблемой, остро стоящей перед органами здравоохранения, является постоянно растущее количество редких заболеваний, для лечения которых не имеется соответствующих лекарственных препаратов. К числу наиболее распространенных причин, ограничивающих разработку и выпуск новых орфанных препаратов, относятся недостаточное стимулирование производителей и отсутствие единого перечня документации, необходимой для оформления заявки на их регистрацию.
Законы, регламентирующие разработку, сертификацию и применение орфанных препаратов
Принятие законов по орфанным препаратам обеспечивает предоставление стимулов и льгот для фармацевтических компаний, занимающихся разработкой и производством медицинских препаратов для лечения редких заболеваний.
Первый закон об орфанных препаратах был принят в США в 1983 году. В 1990-х годах аналогичные законы приняли сначала Япония, а затем Австралия.
В Европе коренной перелом в отношении орфанных препаратов наступил в 1999 году после принятия Директивы по орфанным (сиротским) медицинским препаратам (Директива ЕС № 141/2000). Директива была принята Европейским Парламентом 16 декабря 1999 года и опубликована в январе 2000 года.
Организация EURORDIS, представляющая интересы общеевропейского сообщества пациентов с редкими заболеваниями, способствовала принятию Директивы, активно выступая в ее поддержку. Сразу же после принятия Директивы в составе Европейского агентства по лекарственным средствам был создан Комитет по орфанным препаратам (COMP) для рассмотрения поступающих из стран ЕС заявок о предоставлении лекарственным препаратам статуса орфанных/«сиротских».
История принятия законов по орфанным препаратам
1983 г. – В США принят первый в истории мирового здравоохранения Закон об орфанных препаратах 1990-е – Законы, регламентирующие разработку, производство и использование орфанных препаратов, принимаются в Сингапуре (1991 г.), Японии (1993 г.) и Австралии (1997 г.) 1999 г. – Европейский Парламент принимает Директиву по орфанным/ сиротским медицинским препаратам 2000 г. – В составе Европейского агентства по лекарственным средствам (EMA) со штаб-квартирой в Лондоне создается Комитет по лекарственным средствам для лечения редких заболеваний (COMP)
Льготы и стимулы для производителей, предусмотренные Директивой ЕС:
Предоставление исключительных прав по выпуску лекарств на европейский рынок
Регистрационное удостоверение, подтверждающее статус орфанного/сиротского препарата, выдается EMA (Европейским агентством по лекарственным средствам). После его выдачи медицинские препараты с аналогичными свойствами, разработанные другими производителями, будут допущены на рынок не ранее чем через 10 лет. Производители орфанных препаратов, применяемых в педиатрии, пользуются монопольным правом на выпуск прошедших регистрацию лекарственных средств в течение 12 лет.
Помощь по составлению протоколов исследований
EMA предлагает фармацевтическим компаниям помощь по оформлению протоколов исследований (консультации по различным научным аспектам разработки орфанных препаратов) в форме консультаций по вопросам организации различных тестов и клинических испытаний, проводимых в процессе разработки новых лекарственных средств. В целях оптимизации процедуры разработки орфанных препаратов и обеспечения ее максимального соответствия общеевропейским нормативным требованиям вся необходимая информация предоставляется бесплатно или со значительными скидками.
Скидки
Услуги по рассмотрению заявок на присвоение медицинским препаратам статуса орфанных рассматриваются бесплатно или с предоставлением значительных скидок, которые распространяются на сбор за оформление регистрационного удостоверения, а также на стоимость проведения инспекционных проверок, внесения изменений в информацию о препарате и оказания помощи по оформлению протоколов исследований.
Проведение исследований, финансируемых из бюджета ЕС
Фармацевтические компании, занимающиеся разработкой орфанных препаратов, могут претендовать на получение целевых грантов в рамках соответствующих программ, осуществляемых на уровне ЕС и отдельных стран, а также инициатив, направленных на проведение исследований в области разработки лекарственных средств для лечения редких заболеваний, включая рамочные программы ЕС в области здравоохранения.
Централизованная процедура сертификации орфанных препаратов, применяемая на общеевропейском уровне
На предлагаемой вашему вниманию иллюстрации показаны все этапы централизованной процедуры сертификации орфанных препаратов в Европе, начиная с подачи заявки на присвоение препарату статуса орфанного и заканчивая выдачей регистрационного удостоверения, дающего производителю право на производство и распространение конкретного лекарственного средства.
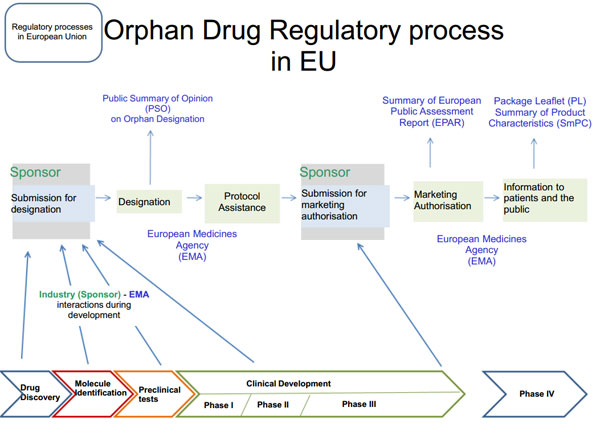
Источник http://www.eurordis.org